Am 5. Juli startete Novo Nordisk in China eine klinische Phase-III-Studie zur CagriSema-Injektion, deren Zweck darin besteht, die Sicherheit und Wirksamkeit der CagriSema-Injektion mit Semeglutid bei adipösen und übergewichtigen Patienten in China zu vergleichen.
Bei der CagriSema-Injektion handelt es sich um eine langwirksame Kombinationstherapie, die von Novo Nordisk entwickelt wird. Die Hauptbestandteile sind der GLP-1-Rezeptoragonist (Glucagon-like-Peptid-1) Smeglutid und ein langwirksames Amylin-Analogon Cagrilintid.Die CagriSema-Injektion kann einmal pro Woche subkutan verabreicht werden.
Das Hauptziel bestand darin, CagriSema (2,4 mg/2,4 mg) einmal wöchentlich subkutan mit Semeglutid oder Placebo zu vergleichen.Novo Nordisk hat die Ergebnisse einer Studie mit CagriSema zur Behandlung von Diabetes im Stadium 2 bekannt gegeben, die bewiesen hat, dass die hypoglykämische Wirkung von CagriSema besser ist als die von Semeglutid und fast 90 % der Probanden das HbA1c-Ziel erreicht haben.
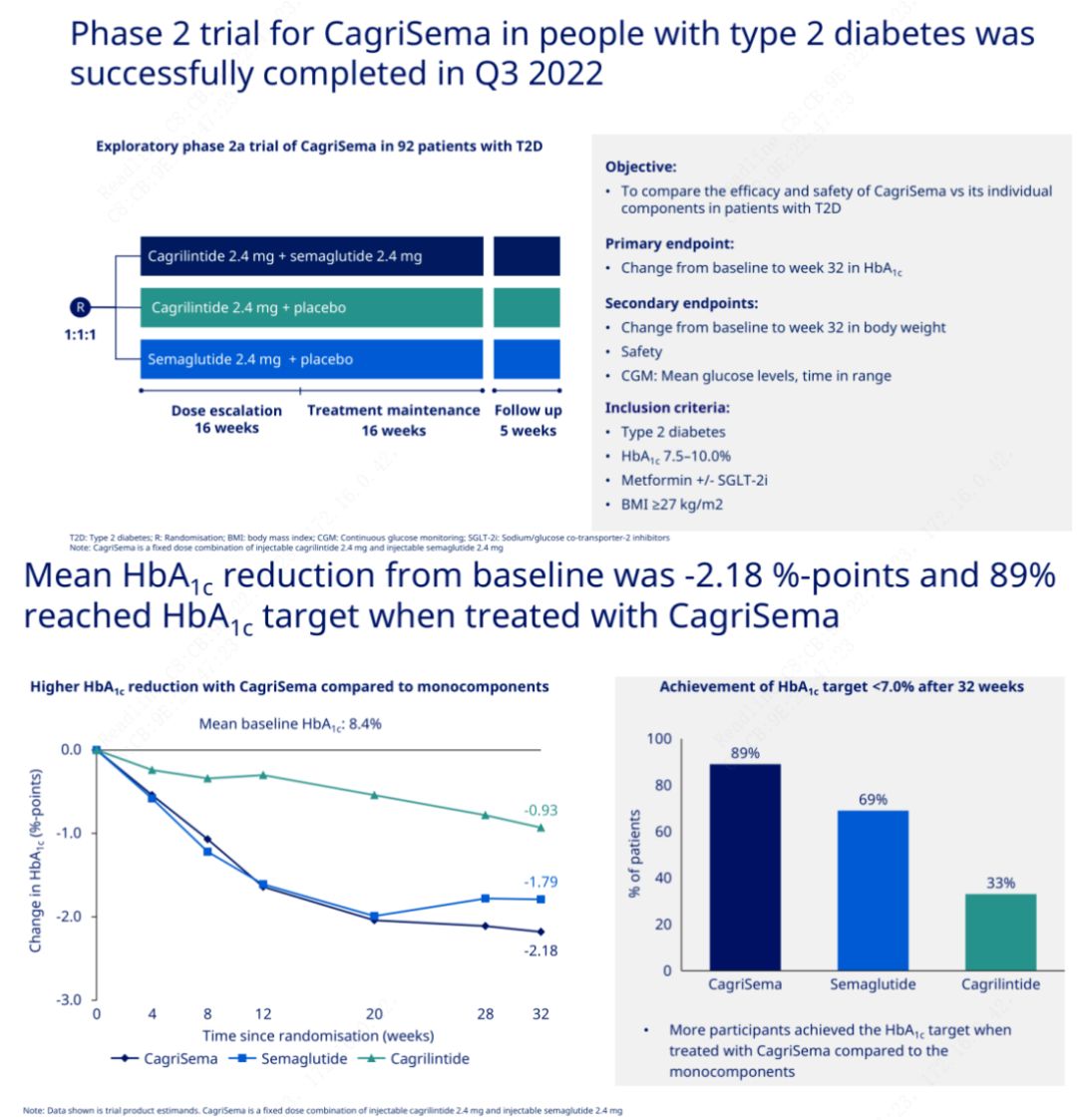
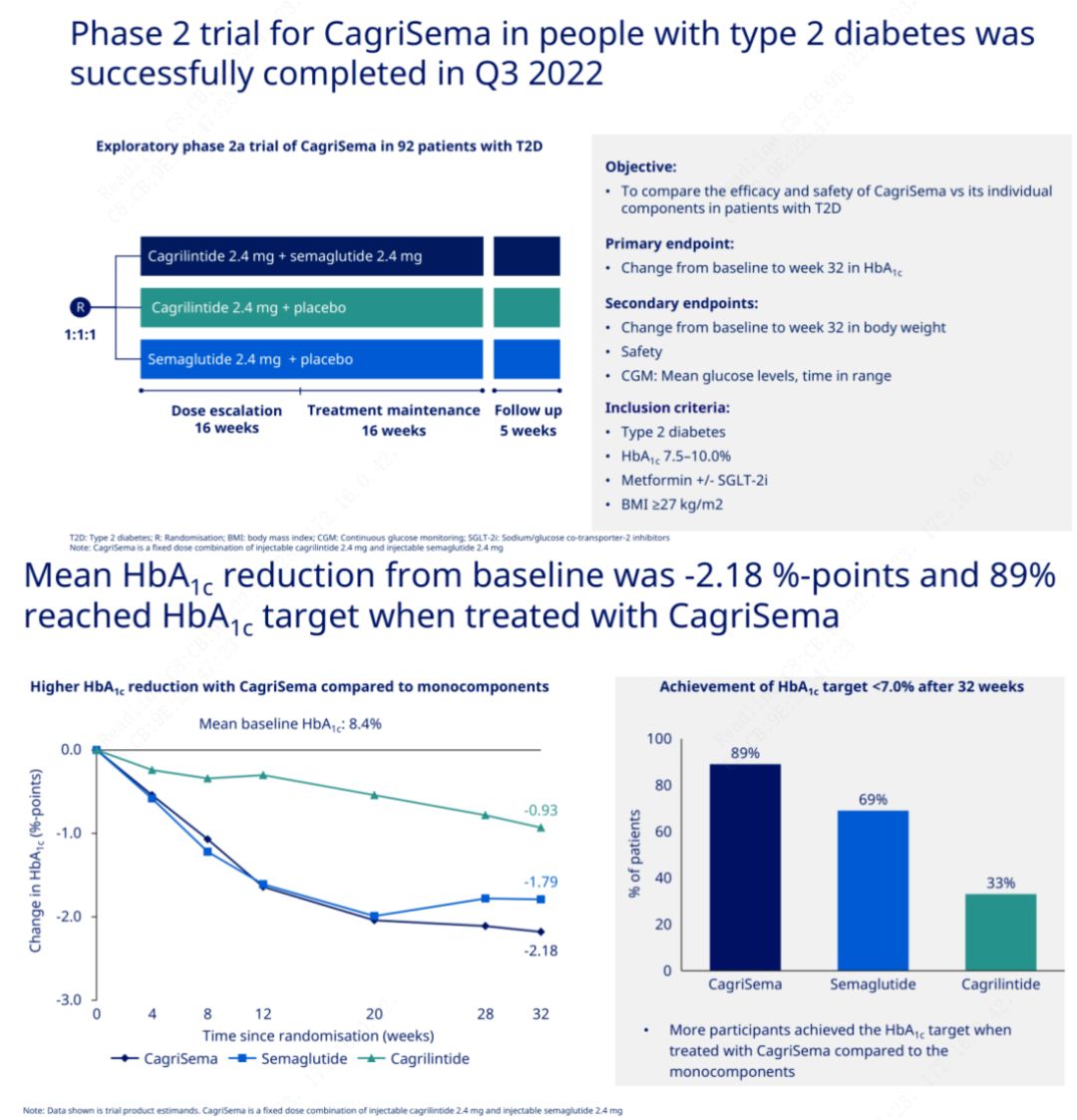
Die Daten zeigten, dass die CagriSema-Injektion zusätzlich zu der signifikanten hypoglykämischen Wirkung hinsichtlich des Gewichtsverlusts Semeglutid (5,1 %) und Cagrilintid (8,1 %) mit einem Gewichtsverlust von 15,6 % deutlich übertraf.
Das innovative Medikament Tirzepatide ist der weltweit erste zugelassene wöchentliche GIP/GLP-1-Rezeptoragonist.Es kombiniert die Wirkung von zwei Inkretinen in einem einzigen Molekül, das einmal pro Woche injiziert wird und eine neue Klasse von Behandlungen für Typ-2-Diabetes darstellt.Tirzepatid wurde im Mai 2022 von der US-amerikanischen Food and Drug Administration (FDA) zur Verbesserung der Blutzuckerkontrolle (auf Basis der Ernährung und Bewegung) bei Erwachsenen mit Typ-2-Diabetes zugelassen und ist derzeit in der Europäischen Union, Japan und anderen Ländern zugelassen.
Am 5. Juli kündigte Eli Lilly eine Phase-III-Studie SURPASS-CN-MONO zur Registrierungs- und Informationsoffenlegungsplattform für klinische Arzneimittelstudien zur Behandlung von Typ-2-Diabetes-Patienten an.SURPASS-CN-MONO ist eine randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie zur Bewertung der Wirksamkeit und Sicherheit einer Tirzepatid-Monotherapie im Vergleich zu Placebo bei Menschen mit Typ-2-Diabetes.Die Studie sollte 200 Patienten mit Typ-2-Diabetes umfassen, die in den 90 Tagen vor Besuch 1 keine Antidiabetika eingenommen hatten (außer in bestimmten klinischen Situationen, wie z. B. akuter Erkrankung, Krankenhausaufenthalt oder geplanter Operation, kurzfristig (≤ 14). Tage) Verwendung von Insulin).
Die Zulassung von Typ-2-Diabetes wird voraussichtlich noch in diesem Jahr erfolgen
Letzten Monat wurden die Ergebnisse einer SURPASS-AP-Combo-Studie am 25. Mai in der Blockbuster-Zeitschrift Nature Medicine veröffentlicht.Die Ergebnisse zeigten, dass Tirzepatid im Vergleich zu Insulin Glargin eine bessere HbA1c- und Gewichtsreduktion bei der Bevölkerung von Typ-2-Diabetes-Patienten im asiatisch-pazifischen Raum (hauptsächlich China) zeigte: HbA1c-Reduktion um bis zu 2,49 % und Gewichtsreduktion um bis zu 7,2 kg (9,4 %) nach 40 Behandlungswochen kam es zu einer deutlichen Verbesserung der Blutfette und des Blutdrucks, und die allgemeine Sicherheit und Verträglichkeit waren gut.
Die klinische Phase-3-Studie zu SURPASS-AP-Combo ist die erste Studie von Tirzepatide, die hauptsächlich an chinesischen Patienten mit Typ-2-Diabetes unter der Leitung von Professor Ji Linong vom Volkskrankenhaus der Universität Peking durchgeführt wurde.SURPASS-AP-Combo steht im Einklang mit den Ergebnissen der globalen SURPASS-Forschungsreihe, die einen weiteren Beweis dafür liefert, dass die Pathophysiologie von Diabetes bei chinesischen Patienten mit der Pathophysiologie von Patienten weltweit übereinstimmt, was die Grundlage für die gleichzeitige Forschung und Entwicklung neuer Medikamente bildet in China und der Welt und bietet außerdem solide Belege dafür, chinesischen Patienten die Möglichkeit zu geben, die neuesten Medikamente zur Diabetesbehandlung und deren klinische Anwendung so schnell wie möglich in China zu nutzen.
Zeitpunkt der Veröffentlichung: 18.09.2023

