Das menschliche Beta-Amyloid (1-42)-Protein, auch bekannt als Aβ 1-42, ist ein Schlüsselfaktor bei der Aufklärung der Geheimnisse der Alzheimer-Krankheit.Dieses Peptid spielt eine zentrale Rolle bei der Bildung von Amyloid-Plaques, rätselhaften Ansammlungen, die das Gehirn von Alzheimer-Patienten schädigen.Mit seiner zerstörerischen Wirkung stört es die neuronale Kommunikation, löst Entzündungen aus und induziert Neurotoxizität, was zu kognitiven Beeinträchtigungen und Nervenschäden führt.Die Untersuchung seiner Aggregations- und Toxizitätsmechanismen ist nicht nur von entscheidender Bedeutung;Es ist eine aufregende Reise zur Lösung des Alzheimer-Rätsels und zur Entwicklung zukünftiger Therapien.



Aβ 1-42 ist ein Peptidfragment aus 42 Aminosäuren, das aus der Spaltung des Amyloid-Vorläuferproteins (APP) durch β- und γ-Sekretasen entsteht.Aβ 1-42 ist einer der Hauptbestandteile der Amyloid-Plaques, die sich im Gehirn von Patienten mit Alzheimer-Krankheit ansammeln, einer neurodegenerativen Erkrankung, die durch kognitive Beeinträchtigung und Gedächtnisverlust gekennzeichnet ist.Es wurde gezeigt, dass Aβ 1-42 verschiedene Funktionen und Anwendungen in der biologischen und biomedizinischen Forschung hat, wie zum Beispiel:
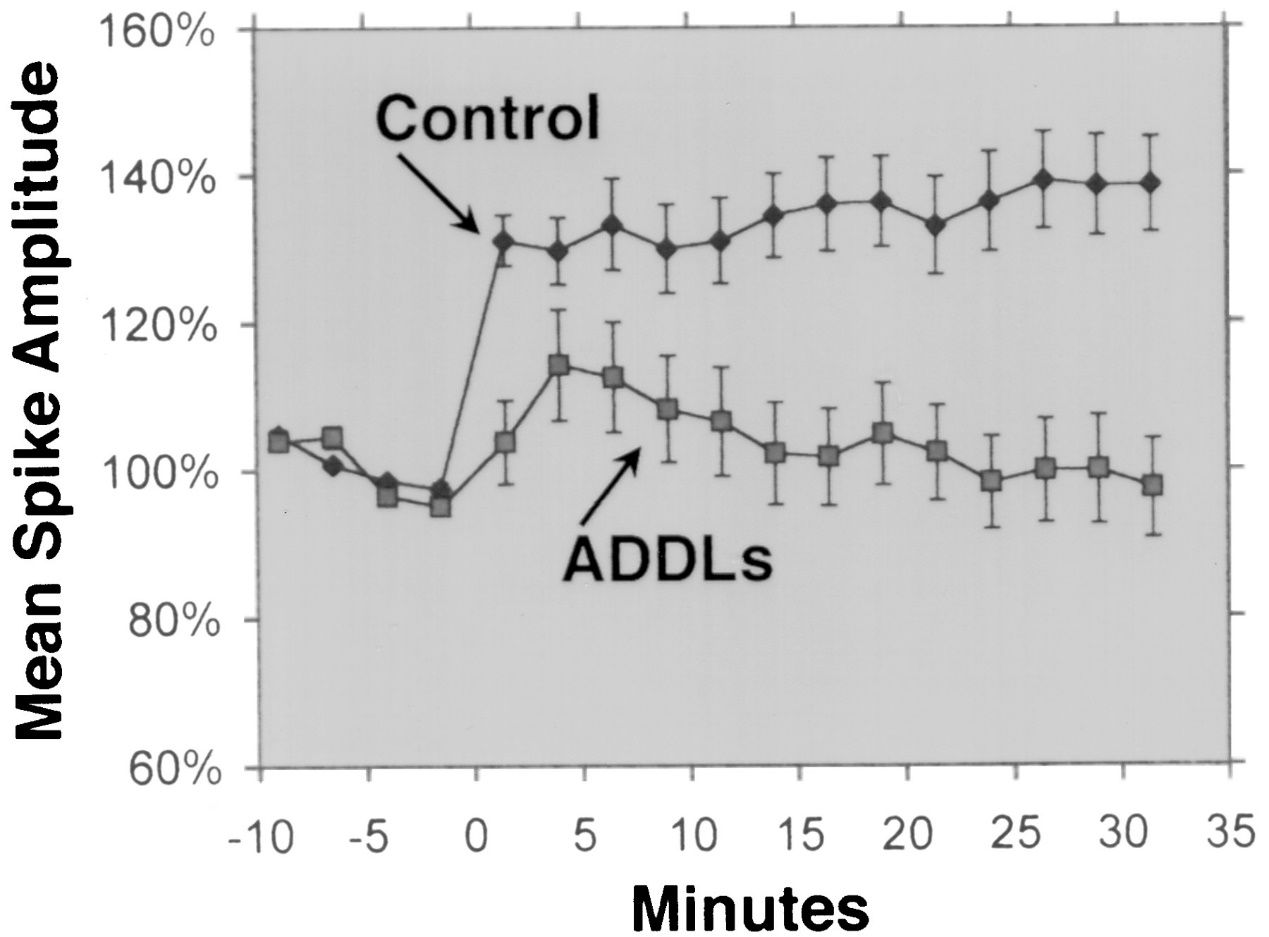
1.Neurotoxizität: Aβ 1-42 kann lösliche Oligomere bilden, die in der Lage sind, sich an neuronale Membranen, Rezeptoren und Synapsen zu binden und deren Funktion zu stören.Diese Oligomere können auch oxidativen Stress, Entzündungen und Apoptose in Neuronen auslösen, was zu synaptischem Verlust und neuronalem Tod führt.Aβ 1-42-Oligomere gelten als neurotoxischer als andere Formen von Aβ, wie beispielsweise Aβ 1-40, die im Gehirn am häufigsten vorkommende Form von Aβ.Es wird auch angenommen, dass sich Aβ 1-42-Oligomere ähnlich wie Prionen von Zelle zu Zelle vermehren und die Fehlfaltung und Aggregation anderer Proteine auslösen können, beispielsweise Tau, das bei der Alzheimer-Krankheit neurofibrilläre Knäuel bildet.
Aβ 1-42 wird allgemein als die Aβ-Isoform mit der höchsten Neurotoxizität angesehen.Mehrere experimentelle Studien haben die Neurotoxizität von Aβ 1-42 unter Verwendung verschiedener Methoden und Modelle nachgewiesen.Beispielsweise haben Lesné et al.(Brain, 2013) untersuchten die Bildung und Toxizität von Aβ-Oligomeren, bei denen es sich um lösliche Aggregate von Aβ-Monomeren handelt, und zeigten, dass Aβ 1-42-Oligomere eine stärkere schädigende Wirkung auf neuronale Synapsen hatten, was zu kognitivem Verfall und neuronalem Verlust führte.Lambert et al.(Proceedings of the National Academy of Sciences, 1998) hoben die Neurotoxizität von Aβ 1-42-Oligomeren hervor und stellten fest, dass sie eine starke toxische Wirkung auf das Zentralnervensystem haben, möglicherweise durch Beeinflussung von Synapsen und Neurotransmittern.Walsh et al.(Nature, 2002) zeigte die hemmende Wirkung von Aβ 1-42-Oligomeren auf die Hippocampus-Langzeitpotenzierung (LTP) in vivo, einen zellulären Mechanismus, der dem Lernen und dem Gedächtnis zugrunde liegt.Diese Hemmung war mit Gedächtnis- und Lernstörungen verbunden, was den Einfluss von Aβ 1-42-Oligomeren auf die synaptische Plastizität unterstreicht.Shankar et al.(Nature Medicine, 2008) isolierten Aβ 1-42-Dimere direkt aus Alzheimer-Gehirnen und zeigten ihre Wirkung auf die synaptische Plastizität und das Gedächtnis, was empirische Beweise für die Neurotoxizität von Aβ 1-42-Oligomeren lieferte.
Darüber hinaus haben Su et al.(Molecular & Cellular Toxicology, 2019) führten eine Transkriptomik- und Proteomikanalyse der Aβ 1-42-induzierten Neurotoxizität in SH-SY5Y-Neuroblastomzellen durch.Sie identifizierten mehrere Gene und Proteine, die von Aβ 1-42 in Signalwegen beeinflusst werden, die mit dem apoptotischen Prozess, der Proteintranslation, dem cAMP-Katabolprozess und der Reaktion auf endoplasmatischen Retikulumstress zusammenhängen.Takeda et al.(Biological Trace Element Research, 2020) untersuchte die Rolle von extrazellulärem Zn2+ bei der durch Aβ 1-42 induzierten Neurotoxizität bei der Alzheimer-Krankheit.Sie zeigten, dass die durch Aβ 1-42 induzierte intrazelluläre Zn2+-Toxizität mit zunehmendem Alter aufgrund des altersbedingten Anstiegs des extrazellulären Zn2+ beschleunigt wurde.Sie schlugen vor, dass die kontinuierliche Sekretion von Aβ 1-42 aus Neuronenenden über eine intrazelluläre Zn2+-Dysregulation zu einem altersbedingten kognitiven Rückgang und Neurodegeneration führt.Diese Studien legen nahe, dass Aβ 1-42 ein Schlüsselfaktor bei der Vermittlung von Neurotoxizität und Krankheitsprogression bei der Alzheimer-Krankheit ist, indem es verschiedene molekulare und zelluläre Prozesse im Gehirn beeinflusst.
2. Antimikrobielle Aktivität: Es wurde berichtet, dass Aβ 1-42 eine antimikrobielle Aktivität gegen verschiedene Krankheitserreger wie Bakterien, Pilze und Viren besitzt.Aβ 1-42 kann sich an die Membranen mikrobieller Zellen binden und diese zerstören, was zu deren Lyse und Tod führt.Aβ 1-42 kann auch das angeborene Immunsystem aktivieren und Entzündungszellen an die Infektionsstelle rekrutieren.Einige Studien deuten darauf hin, dass die Ansammlung von Aβ im Gehirn eine schützende Reaktion auf chronische Infektionen oder Verletzungen sein könnte.Allerdings kann eine übermäßige oder fehlregulierte Produktion von Aβ auch zu Kollateralschäden an den Wirtszellen und -geweben führen.
Es wurde berichtet, dass Aβ 1-42 eine antimikrobielle Aktivität gegen eine Reihe von Krankheitserregern wie Bakterien, Pilzen und Viren wie Staphylococcus aureus, Escherichia coli, Candida albicans und Herpes-simplex-Virus Typ 1 zeigt, indem es mit deren Membranen interagiert und was zu ihrer Störung und Lyse führt.Kumar et al.(Journal of Alzheimer's Disease, 2016) demonstrierten diesen Effekt, indem sie zeigten, dass Aβ 1-42 die Membranpermeabilität und Morphologie mikrobieller Zellen veränderte, was zu deren Tod führte.Zusätzlich zu seiner direkten antimikrobiellen Wirkung kann Aβ 1-42 auch die angeborene Immunantwort modulieren und Entzündungszellen an die Infektionsstelle rekrutieren.Soscia et al.(PLoS One, 2010) zeigten diese Rolle, indem sie berichteten, dass Aβ 1-42 die Produktion von proinflammatorischen Zytokinen und Chemokinen wie Interleukin-6 (IL-6), Tumornekrosefaktor-alpha (TNF-α) und Monozyten stimuliert Chemoattraktives Protein-1 (MCP-1) und Makrophagen-Entzündungsprotein-1 Alpha (MIP-1α) in Mikroglia und Astrozyten, den wichtigsten Immunzellen im Gehirn.
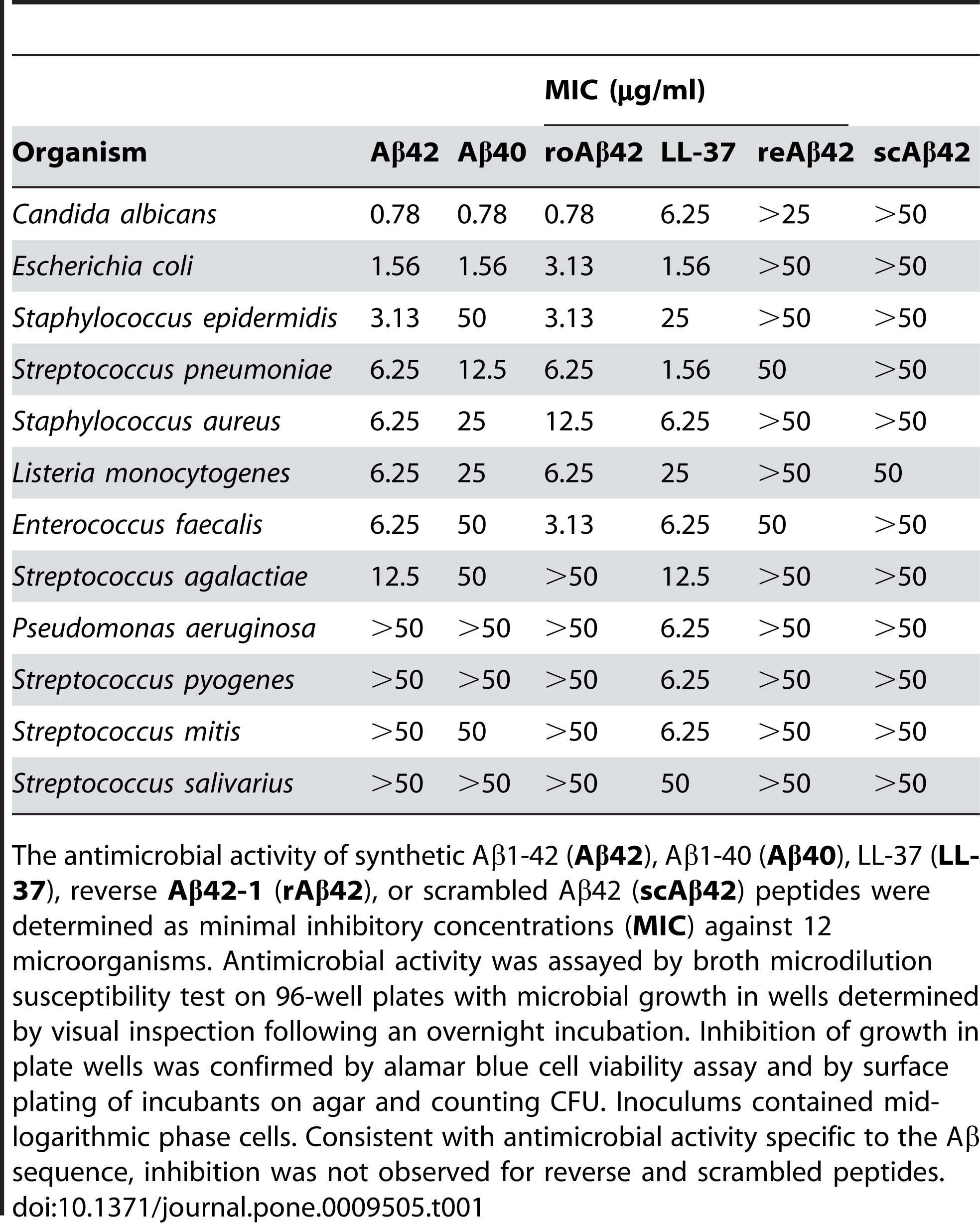
Abbildung 2. Aβ-Peptide besitzen antimikrobielle Aktivität.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. Das mit der Alzheimer-Krankheit assoziierte Amyloid-Beta-Protein ist ein antimikrobielles Peptid. PLoS One . 3. März 2010;5(3):e9505.)
Während einige Studien darauf hindeuten, dass die Ansammlung von Aβ im Gehirn eine schützende Reaktion auf chronische Infektionen oder Verletzungen sein könnte, da Aβ als antimikrobielles Peptid (AMP) wirken und potenzielle Krankheitserreger eliminieren kann, bleibt das komplexe Zusammenspiel zwischen Aβ und mikrobiellen Elementen bestehen Gegenstand der Untersuchung.Das empfindliche Gleichgewicht wird durch die Forschung von Moir et al. hervorgehoben.(Journal of Alzheimer's Disease, 2018), was darauf hindeutet, dass eine unausgewogene oder übermäßige Aβ-Produktion unbeabsichtigt Wirtszellen und -gewebe schädigen kann, was die komplexe Doppelnatur der Rolle von Aβ bei Infektionen und Neurodegeneration widerspiegelt.Eine übermäßige oder fehlregulierte Produktion von Aβ kann zu seiner Aggregation und Ablagerung im Gehirn führen und toxische Oligomere und Fibrillen bilden, die die neuronale Funktion beeinträchtigen und eine Neuroinflammation auslösen.Diese pathologischen Prozesse sind mit kognitivem Verfall und Gedächtnisverlust bei der Alzheimer-Krankheit verbunden, einer neurodegenerativen Erkrankung, die durch fortschreitende Demenz gekennzeichnet ist.Daher ist das Gleichgewicht zwischen den positiven und schädlichen Wirkungen von Aβ entscheidend für die Erhaltung der Gehirngesundheit und die Verhinderung von Neurodegeneration.
3. Eisenexport: Es wurde gezeigt, dass Aβ 1-42 an der Regulierung der Eisenhomöostase im Gehirn beteiligt ist.Eisen ist ein essentielles Element für viele biologische Prozesse, aber überschüssiges Eisen kann auch oxidativen Stress und Neurodegeneration verursachen.Aβ 1-42 kann an Eisen binden und dessen Export aus Neuronen über Ferroportin, einen Transmembran-Eisentransporter, erleichtern.Dies kann dazu beitragen, die Ansammlung und Toxizität von Eisen im Gehirn zu verhindern, da überschüssiges Eisen oxidativen Stress und Neurodegeneration verursachen kann.Duce et al.(Cell, 2010) berichteten, dass Aβ 1-42 an Ferroportin bindet und dessen Expression und Aktivität in Neuronen erhöht, was zu einem verringerten intrazellulären Eisenspiegel führt.Sie zeigten auch, dass Aβ 1-42 die Expression von Hepcidin, einem Hormon, das Ferroportin hemmt, in Astrozyten reduzierte, was den Eisenexport aus Neuronen weiter steigerte.Eisengebundenes Aβ kann jedoch auch anfälliger für Aggregation und Ablagerung im extrazellulären Raum werden und Amyloid-Plaques bilden.Ayton et al.(Journal of Biological Chemistry, 2015) berichteten, dass Eisen die Bildung von Aβ-Oligomeren und -Fibrillen in vitro und in vivo förderte.Sie zeigten auch, dass die Eisenchelatbildung die Aβ-Aggregation und -Ablagerung in transgenen Mäusen reduzierte.Daher ist das Gleichgewicht zwischen den positiven und schädlichen Auswirkungen von Aβ 1-42 auf die Eisenhomöostase von entscheidender Bedeutung für die Aufrechterhaltung der Gehirngesundheit und die Verhinderung von Neurodegeneration.
Wir sind ein Polypeptidhersteller in China mit mehrjähriger Erfahrung in der Polypeptidproduktion.Hangzhou Taijia Biotech Co., Ltd. ist ein professioneller Polypeptid-Rohstoffhersteller, der Zehntausende Polypeptid-Rohstoffe bereitstellen und auch je nach Bedarf anpassen kann.Die Qualität der Polypeptidprodukte ist ausgezeichnet und die Reinheit kann 98 % erreichen, was von Anwendern auf der ganzen Welt anerkannt wird. Nehmen Sie gerne Kontakt mit uns auf.






